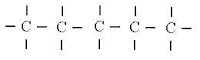| Cadeia | Característica | Exemplo |
| Aberta ou Acílica ou Alifática | apresenta extremos livres | |
| Fechada ou Cíclica | não apresenta extremos livres e forma um ciclo | |
| Normal (aberta) | apenas dois extremos livres | |
| Ramificada (aberta) | mais de dois extremos livres | |
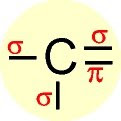
| Saturada (aberta ou fechada) | somente ligação simples entre átomos de carbono | |
| Insaturada ou não-saturada (aberta ou fechada) | pelo menos uma ligação dupla ou tripla entre átomos de carbono | |
| Heterogênea (aberta ou fechada) | apresenta heteroátomo (S, O, N, P entre átomos de carbono) | |
| Homogênea | não apresenta heteroátomo | |
| Aromática | possui anel benzênico ou aromático | |
| Alicíclica (fechada) | não possui anel benzênico ou aromático | |
| Mista | ciclo e extremo livre |