segunda-feira, 4 de maio de 2009
Curiosidades
• Você pode por um bife em uma vasilha com Coca-Cola e ele desaparecerá em dois dias.
• Para remover manchas em pára-choques cromados de carros antigos, esfregue a peça com um pedaço de papel alumínio amassado embebido em Coca-Cola.
• A Coca-Cola é um ótimo desentupidor de pia, pois dissolve a gordura nos canos.
• Os óculos ficarão brilhando se você limpar com vinagre. Uma gota em cada lente é o suficiente.
• O ferro de passar roupa desliza mais facilmente sobre as roupas se você usar pasta de dente no fundo do ferro.
• Para evitar cheiro na geladeira coloque uma caixa de bicarbonato de sódio aberta. Ele absorve completamente todos os odores dos alimentos guardados.
Como funciona o air bag dos carros?
O air bag é formado por um dispositivo que contém azida de sódio, NaN3. Este dispositivo está acoplado a um balão, que fica no painel do automóvel. Quando occore uma colisão, sensores instalados no pára-choques do automóvel e que estão ligados ao dispositivo com azida de sódio, produzem uma faísca, que aciona a decomposição do NaN3:2NaN3(s) + O2 ® 3N2(g) + Na2O2(s)
Alguns centésimos de segundo depois, o air bag está completamente inflado, salvando vidas.
Qual é o composto com o cheiro mais desagradável que existe?
Muitos compostos de enxofre com baixo peso molecular produzem reações adversas nas pessoas, mesmo se elas nunca tiveram contato com estes compostos antes, como as emissões do gambá (n-butiltiol). O ácido butanóico faz lembrar o cheiro de vômito e putricina (1,4-butanodiamina) e cadaverina (1,5-pentanodiamina) lembram a carne podre.
FONTE:
http://www.energia.com.br/professores/alquimistas/curiosidades/curiosidades.html
Funçoes oxigenadas
Álcoóis e Fenóis
Álcoóis
São compostos orgânicos que possuem uma ou mais hidroxilas (-OH) ligadas a átomos de carbono saturado. Veja:
CH3 - CH2 - OH
Nomenclatura:
OFICIAL:
Prefixo de carbonos + ind. de ligação + OL;
a numeração da cadeia principal começa pela extremidade mais próxima da hidroxila.
USUAL:
Palavra álcool _________________ + ICO
Nome do radical
Exemplos:
CH3 - CH2
OFICIAL: etanol USUAL: álcool metílico
CH3 - CH - CH2 - CH3
|
OH
OFICIAL: 2 butanol USUAL: álcool sec-butílico
Classificação:
De acordo com a quantidade de – OH:
Monoalcoóis: apresentam 1 OH.
Dialcoóis: apresentam 2 OH.
Trialcoóis: apresentam 3 OH.
De acordo com a posição do radical:
Álcool primário: o grupo – OH se liga a carbono primário.
Secundário: liga-se a carbono secundário.
Terciário: liga-se a carbono terciário.
Fenóis
Compostos orgânicos que possuem uma ou mais hidroxilas ou oxidrilas ( OH- ) ligadas diretamente ao anel benzênico. Observe:
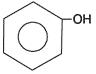
Nomenclatura:
Usamos o prefixo hidroxi.
A numeração começa na hidroxila.
Aplicação
Dê a nomenclatura IUPAC do composto:
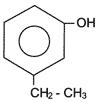
Solução:
Hidroxi - 3 - etil benzeno
Enóis e Éteres
Enóis
São compostos orgânicos que apresentam a hidroxila ligada a um átomo de carbono insaturado(ligação dupla). Estes composto formam isômeros de função especiais (tautômeros) onde a ligação dupla muda de posição com o oxigênio, formando um novo composto. esta situação é reversível.
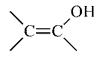
São compostos instáveis, pois os elétrons da ligação entre os carbonos são facilmente atraídos pelo oxigênio do grupo – OH, o que provoca um rearranjo na molécula, que acaba transformando-se numa outra função (aldeído ou cetona).

Éteres
São compostos em que o oxigênio está diretamente ligado a dois radicais orgânicos:
R1 – O – R2
Exemplo:
CH3 - CH2 - O - CH2 - CH3
CH3 - O - CH2 - CH3
Nomenclatura:
OFICIAL:
________________ OXI - _________________
Radical menor Cadeia do Radical maior
USUAL:
Éter ___________ - ____________ ÍLICO
Radical menor Radical maior
Exemplos:
CH3 - CH2 - O - CH2 - CH3
OFICIAL: etoxi-etano
USUAL: eter-dietílico
CH3 - O - CH2 - CH3
OFICIAL: metoxi-etano
USUAL: eter-metil-etílico
Aldeídos
São compostos orgânicos que possuem radical ou grupo funcional aldoxila.
Nomenclatura:
Oficial:
_________________ + ind. ligação + AL
Pref. de carbonos
Usual:
Aldeído ______________
Complemento
Esse complemento será:
a) fórmico – 1 carbono;
b) acético – 2 carbonos;
c) propílico – 3 carbonos;
d) butílico – 4 carbonos;
e) valérico – 5 carbonos;
Cetonas
São compostos orgânicos que possuem o radical ou grupo funcional carbonila.
Nomenclatura:
OFICIAL:
_______________ + indicativo de ligação + ONA
Prefixo
USUAL:
_______________ - ________________ CETONA
Radical menor Radical maior
Exemplos:
a)
OFICIAL: propanona
USUAL: dimetil cetona ou acetona (cetona comum)
b)
OFICIAL: butanona
USUAL: metil-etil-cetona
c)
OFICIAL: 2-pentanona
USUAL: metil-propil-cetona
d)
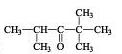
OFICIAL: 2,2,4- trimetil pentanona
USUAL: isopropil-terc-butil cetona
Ácidos Carboxílicos e seus derivados
Ácidos Carboxílicos
São compostos orgânicos com um ou mais radicais carboxila.
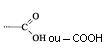
OFICIAL:
______________ + indicativo de ligação + ÓICO
Prefixo
USUAL:
Ácido ________________
Complemento
Os complementos são os mesmos dos aldeídos.
Fórmico – 1 carbono.
Acético – 2 carbonos.
Propílico – 3 carbonos.
Butírico – 4 carbonos.
Valérico – 5 carbonos.
Exemplo:
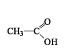
Ácidos Carboxílicos
Nomenclatura:
____________ ETO DE __________
Halogênio Radical
Anidrido
São compostos obtidos a partir de ácidos por meio de uma desidratação.
Exemplo:
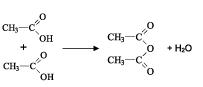
Nomenclatura:
Anidrido ________________________________
Nome do ácido correspondente
PARTICULARIDADES DOS áCIDOS CARBOXILICOS

particularidades dos Ácidos carboxílicos
Ésteres –As essências de flores e frutos são ésteres formados por um ácido e por um álcool, ambos de baixo conteúdo carbônico: o metanoato e o etanoato de isobutila são os ésteres determinantes do aroma da framboesa. Veja outros:
Metanoato e heptanoato de etila – Uva.
Etanoato de pentila – Banana.
Etanoato de isopentila – Pêra.
Etanoato de octila – Laranja.
Etanoato de benzila – Jasmim.
Propanoato e butanoato de etila – Maçã.
Butanoato de metila – Pinha.
Butanoato de etila – Morango.
Butanoato de butila – Damasco.
Hexanoato de etila – Abacaxi.
As ceras são ésteres formados por um ácido graxo e por um álcool com grande conteúdo carbônico. São usados na fabricação de cera de assoalho, velas e sabões.
Os glicerídeos são ésteres formados por um ácido graxo e por um propanotriol (glicerina). Eles dividem-se em óleos, quando o ácido graxo é insaturado, e em gorduras, quando o ácido graxo é saturado.
Haletos orgânicos – A partir do cloroeteno (cloreto de vinila) é produzido o PVC, matéria-prima para a confecção de canos plásticos, mangueiras, reservatórios para líquidos, frascos para xampus e alimentos, carteiras, bolsas, filmes para embalar alimentos.
O DDT (diclorodifeniltricloroetano) e o BHC (1, 2, 3, 4, 5, 6-hexaclorociclohexano) são inseticidas importantes.
O clorofórmio, ou triclorometano, é usado como solvente e como anestésico; o cloroetano é usado como anestésico; o tricloroetileno, na limpeza de metais e para retirar gorduras; já o tetracloroetileno é usado na lavagem de roupas a seco.
Sais Orgânicos e Ésteres
OFICIAL: ácido etanóico
USUAL: ácido acético (presente no vinagre)
Observação – O grupo funcional (dos aldeídos, cetonas e ácidos carboxílicos) pode aparecer mais de uma vez. Neste caso usamos di, tri, etc precedendo a terminação. Veja:
![]()
OFICIAL: ácido propanodióico
USUAL: ácido malônico
Sais Orgânicos
São normalmente obtidos pela reação entre um ácido carboxílico e uma base.
Exemplo:![]()
Nomenclatura:
OFICIAL:
______ + ind. de ligação + OATO DE ___________
Prefixo Nome do metal
Exemplo:![]()
Propanoato de potássio
Ésteres
São normalmente obtidos pela reação entre um ácido carboxílico e um álcool, através de uma reação chamada de esterificação, que produz água e éster.
Apresentam o grupo![]()
Nomenclatura:
Cadeia de R + OATO DE Prefixo R1 + ILA
Observação: Os radicais também podem ser do tipo ARILA
Exemplo:![]()
ac. etanóico + metanol etanoato de metila + água
Observação:
Depois que a substância responsável pelo aroma de uma fruta, ou de uma flor, é identificada, os químicos tentam reproduzi-la em laboratório.
Se eles têm sucesso, surge mais um aroma artificial ou sintético, que é apenas um dos tipos de aditivo que impregnam os produtos da indústria farmacêutica, de cosméticos e de alimentos.
Óleo x gordura: qual a diferença?
Óleos e gorduras são ésteres. Os primeiros são ésteres líquidos, e as gorduras, ésteres sólidos
Haletos de ácidos
São compostos orgânicos derivados da substituição da hidroxila da carboxila por um halogênio (Cl, Br ou I).
![]()
Dos haletos de ácido, os mais importantes são os que possuem o gripo cloro (-Cl), denominados de acido ou cloretos de acila.
domingo, 3 de maio de 2009
Características e Nomenclatura de Hidrocarbonetos Alifáticos
Alcanos
Fórmula geral; CnH2n+2
- Alquenos, alceno ou olefinas: são hidrocarbonetos alifáticos insaturados que apresentam uma dupla ligação.
Fórmula geral: CnH2n
- Alquinos ou alcinos: são hidrocarbonetos alifáticos insaturados por uma tripla ligação.
Fórmula geral: CnH2n-2
- Alcadinos ou dienos: são hidrocarbonetos alifáticos insaturados por duas ligações duplas.
Fórmula geral: CnH2n-2
Hidrocarbonetos Cíclicos
- Cicloalcanos, ciclanos ou cicloparafinas: apresentam cadeia fechada com simples ligações apenas.
Fórmula geral: CnH2n
- Cicloalquenos, cicloalcenos ou ciclenos: são hidrocarbonetos cíclicos insaturados por uma dupla ligação.
- Aromáticos: são hidrocarbonetos cuja estrutura existe pelo menos um anel benzênico ou aromático, nos quais se verifica o fenômeno da ressonância.
Grupos Orgânicos Substituintes e Radicais
Cisão de ligações; as ligações covalentes podem ser rompidas pelo fornecimento de energia. A cisão irá ser de duas maneiras diferentes devido à quantidade de energia.
• Heterólise; quebra da ligação em que uma das espécies ganha elétrons e a outra perde.
• Homólise; quebra da ligação sem ganho e nem perda de elétrons.
Radicais; são agrupamentos ou átomos eletricamente neutros que apresentam pelo menos um elétron de valência livre, podendo ser representados geralmente por R—.
Grupos substituintes; os compostos orgânicos também têm a capacidade de originar radicais, quando essas espécies orgânicas aparecem substituindo um ou mais átomos de hidrogênio de uma estrutura orgânica, elas são denominadas Grupos orgânicos substituintes.
Nomenclatura de Hidrocarbonetos Ramificados
Alcanos
Regra 1
Determinar a cadeia principal e seu nome.
Regra 2
Reconhecer os grupos e dar nomes a eles.
Regra 3
Numerar a cadeia principal de modo que se obtenha os menores algarismos possíveis para indicar as posições dos grupos.
Grupos iguais
Os nomes devem ser precedidos de prefixos que indicam suas qualidades: di, tri, tetra, etc.
Grupos diferentes
É recomendável que os grupos sejam escritos em ordem alfabética. Os prefixos sec, terc, di, tri não são considerados para efeito de ordem alfabética.
Alquenos
A nomenclatura desses hidrocarbonetos seguem basicamente as mesmas regras utilizadas para os Alcanos. A única diferença está na presença de insaturações que devem obrigatoriamente fazer parte da cadeia principal.
Cicloalcanos e aromáticos; o ciclo ou anel é considerado a cadeia principal.
Cicloalcanos
As regras são as mesmas dos demais, considerando-se a quantidade e a posição dos grupos substituintes. Quando o ciclo apresentar um único radical, não há necessidades de indicar sua posição.
Aromáticos
Quando sua cadeia principal apresentar apenas um anel benzênico, ela é chamada benzeno e pode apresentar um ou mais grupos substituintes.
Quando houver um único radical, seu nome deve proceder à palavra benzeno, sem numeração.
terça-feira, 28 de abril de 2009
Quimica organica-exercicios
a) é um elemento que está em um grupo central (14).
b) forma cadeias.
c) pode formar ligações sigma e pi.
d) tem variabilidade do número de oxidação.
e) é tetravalente.
2-(UNIVALI/99) A maioria dos combustíveis de uso diário consiste de misturas de hidrocarbonetos derivados do petróleo: gás de cozinha, gasolina, querosene e óleo diesel. A queima desses combustíveis representa, no momento, uma das maiores fontes de energia para a humanidade. Esses combustíveis são misturas de substâncias constituídas principalmente por moléculas que contêm átomos de carbono e de:
a) Enxofre, b) Oxigênio, c) Halogênio, d) Nitrogênio, e) Hidrogênio.
3-(IMEC) O composto de fórmula molecular C8H18 é:
a) um alceno com 18 átomos de carbono.
b) um alcino com 8 átomos de carbono.
c) um alceno com 18 hidrogênios.
d) um alcano com 8 átomos de carbono.
e) um alceno com 8 átomos de hidrogênio.
4-Qual o nome do composto formado pela união dos radicais propil e tercbutil?
5-(RRN) Um composto orgânico cuja fórmula geral é representada por CnH2n pertence à classe do:
a) alceno ou cicloalceno.
b) Alcano ou cicloalcano.
c) Alceno ou cicloparafina.
d) Alcino ou alcadieno.
e) Alcino ou aromático.
6-. Escreva a fórmula estrutural de um hidrocarboneto que apresenta as seguintes características:
a) possui 4 C, 1 dupla ligação e 1 ramificação.
b) Possui 6 C, 2 duplas ligações e 2 ramificações.
7- (OSEC-SP) Os compostos classificados como hidrocarbonetos fazem parte de misturas que compõem alguns combustíveis. Esses compostos apresentam em sua constituição os elementos químicos:
a) hidrogênio, carbono e oxigênio.
b) Hidrogênio, carbono e nitrogênio.
c) Hidrogênio e carbono.
d) Hidrogênio, carbono, oxigênio e nitrogênio.
e) Hidrogênio, carbono, oxigênio, enxofre e nitrogênio.
Química Orgânica
a) Possui carbono em sua molécula;
b) Deriva dos seres vivos;
c) Deriva dos vegetais;
d) Possui obrigatoriamente carbono e nitrogênio em sua molécula;
e) N.d.r.
2- A química orgânica estuda:
a) Apenas os compostos produzidos por animais;
b) Todos os compostos que derivam dos seres vivos;
c) Apenas compostos que vieram do planeta Marte;
d) Todos os compostos produzidos por vegetais;
e) N.d.r.
3- Quem lançou a “Teoria da Força Vital”?
a) Berzelius;
b) Kekulé;
c) Wöhler;
d) Bergman;
e) Newton.
4- Qual destes constatou a presença de uréia partindo do cianeto de amônio:
a) Kekulé ;
b) Torricelli;
c) Vant´Hoff;
d) Whöler ;
e) Lavoisier;
5- Qual a definição de carbono primário?
a) é o carbono que está ligado a um átomo de oxigênio e dois de carbono;
b) é o carbono que está ligado apenas por ligação simples a três carbonos e um oxigênio;
c) é o carbono que está ligado a apenas um outro carbono;
d) é o carbono que não se liga a nenhum carbono;
e) é o carbono que está ligado a um carbono secundário;
6- Carbono secundário é aquele que:
a) está ligado a dois carbonos;
b) está ligado a um oxigênio por ligação dupla;
c) na cadeia carbônica é o segundo da esquerda para s direita;
d) está ligado a dois átomos de hidrogênio;
e) n.d.r.
7- Analisando a estrutura da molécula de etano é fácil observar que:
a) os dois carbonos são secundários;
b) os dois carbonos estão a quatro hidrogênios;
c) os dois carbonos são terceários;
d) um carbono é secundário e o outro é primário;
e) os dois carbonos são primários;
8- Na estrutura do 3-etil-3-metil-4-propil-heptano encotramos:
a) 2 carbonos terceários, 5 carbonos secundários, 6 primários;
b) 1 carbono quaternário, 1 carbono terceário, 5 carbonos secundários, 6 carbonos primários;
c) 2 carbonos quaternários, 3 carbonos secundários, 8 carbonos primários;
d) 2 carbonos terceários, 6 carbonos secundários, 5 carbonos primário;
e) 1 carbono quaternário, 1 carbono terceário, 6 cabonos secundários, 5 carbonos primários.
9- Na estrutura do 2-metil-ciclopetano:
a) todos os cabonos são primários;
b) 1carbono é primário e cinco são secudários;
c) todos os carbonos são secundário;
d) 1 carbono é primário 1 é terceário e quatro são secundários;
e) 1 carbono é primário 1 é terceário e cinco são secundários;
10- Na estrutura da naftalina:
a) 2 carbonos são secundários e 8 são primários;
b) 2 carbonos são terceários e 8 são secundários;
c) todos os carbonos são secundários;
d) 2 carbonos são quaternários e 8 são secundários;
e) 1 carbono é quaternário, 1 carbono é terceário e 8 carbonos são secunários.
11- Das substâncias abaixo, qual contém o maior número de carbonos?
a) propilciclobutano
b) metilciclopentano
c) 3-metil-hexano
d) cicloheptano
e) 3-etil-2metilpentano
12- Qual das moléculas abaixo, apresenta cadeia carbônica saturada?
a) benzeno
b) C4H10
c) 3-metil-1-hexeno
d) C3H6
e) Naftalina
13- Uma cadeia é saturada quando:
a) os carbonos estão ligados apenas por ligação simples;
b) a cadeia é constituída apenas por cabonos;
c) há ligação dupla entre carbonos;
d) a cadeia possui mais de dez carbonos;
e) quando há vários heteroátomos na cadeia.
14- Qual das cadeias abaixo é insaturada?
a) 3-metil-octano
b) 2-etil-3-penteno
c) metil-ciclohexano
d) etano
e) propano
15- (PUC-SP) No composto CH3CH2CH2CCCH2CH3 existem:
a) duas ligações sigma e quatro pi;
b) Quinze ligações sigma e três pi;
c) Dezoito ligações sigma e duas ligações pi;
d) Quinze ligações sigma e duas ligações pi;
e) Sete ligações sigma e três ligações pi.
16- Assinale a alternativa que contém a classificação da cadeia do
(CH3)2CH-CH2-C(CH3)2CH3
a) Cíclica, insaturada, ramificada;
b) Acíclica, saturada, normal;
c) Acíclica, insaturada, ramificada;
d) Acíclica, saturada, ramificada;
e) Cíclica, saturada, normal.
17- Assinale a alternativa verdadeira:
a) Cadeia ramificada é aquela que apresenta um heteroátomo ligado a um carbono secundário;
b) Cadeia normal é aquela que não apresenta ligação dupla entre carbonos;
c) Cadeia insaturada é aquela que apresenta ligação pi entre carbonos;
d) Cadeia saturada é aquela em que pelo menos a metade do número de carbonos está ligada a um heteroátomo;
e) Cadeia cíclica é aquela que não forma um ciclo de carbonos.
18- Considere o composto CH2 = CH – CH2 O – CH3. Qual a classificação de sua cadeia?
a) Cíclica, insaturada, homogênea, normal;
b) Acíclica, insaturada, heterogênea, normal;
c) Acíclica, saturada, homogênea, normal;
d) Acíclica, insaturada, heterogênea, ramificada;
e) Cíclica, insaturada, heterogênea, normal.
19- Seja a cadeia CH3 – CH2 – CH = O. Podemos afirmar que a cadeia é:
a) Acíclica, ramificada, insaturada, homogênea;
b) Acíclica, não ramificada, saturada, homogênea;
c) Acíclica, não ramificada, saturada, heterogênea;
d) Acíclica, ramificada, saturada, heterogênea;
e) Acíclica, não ramificada, insaturada, heterogênea.
20- Hidrocarbonetos que apresentam ligação dupla entre os carbonos recebem o nome de:
a) alcanosb) alcenosc) alcinosd) ciclanose) n.d.r.
segunda-feira, 27 de abril de 2009
Teoria das tensões de Bayer
Devido ao fator de o valor do ângulo de ligação entre os carbonos no ciclo diferir do valor normal tetraédrico, existe nessas moléculas um certa tensão, e daí resulta serem elas instáveis, em comparação com as moléculas cujos ângulos de ligação são tetraédricos. A tensão em um ciclo pode ser calculada pela fórmula (109o 5' - a) / 2, onde a é o ângulo entre dois carbonos do ciclo, supondo uma cadeia coplanar. Assim, pela equação, o ciclopropano tem uma tensão de 24o 75', o ciclobutano de 9o 75' e o ciclopentano de 0o 75' (desprezível). O ciclopentano, por ter uma tensão desprezível, já possui uma grande estabilidade, preferindo reações de substituição, como nos alcanos, enquanto o ciclopropano e o ciclobutano, com tensões elevadas, sofrem facilmente ruptura na cadeia, dando reações de adição, como nos alcenos.
E o ciclohexano? Este teria um ângulo coplanar de 120o, o que causaria uma tensão em sentido oposto em relação aos casos citados anteriormente, ou seja, de acordo com a fórmula, a tensão para o ciclohexano seria de -5o 25, que seria uma tensão de distensão. Por isso, o ciclohexano deveria ser muito instável. Porém, ele é mais estável que o ciclopentano e praticamente só dá reação de substituição. Bayer errou, porque os átomos de carbono nas cadeias cíclicas com mais de cinco carbonos não são coplanares, e mantêm o ângulo tetraédrico (109o 5'), sem tensão. No caso do ciclohexano, os carbonos, mantendo o ângulo tetraédrico, podem assumir duas conformações espaciais, que foram denominadas barco e cadeira, por fazerem lembrar esses objetos. No entanto, a estrutura em forma de cadeira é a mais estável delas. Não pela tensão angular, já que ambas têm o mesmo ângulo de ligação (109o 5'), mas pelo fato de a conformação barco apresentar interações não-dirigidas entre os átomos de hidrogênio.
Exercicios fisico-química( solução)
2) (UEM -PR) A concentração molar (mol/L) de uma solução aquosa preparada por adição de 5,3g de Na2CO3 (massa molar 106g/mol) em água até completar 100mL de solução é:
3) Uma recomendação para evitar contaminações pelo bacilo da cólera é deixar legumes e verduras em molho numa solução de um litro de água com uma colher de sopa de água sanitária. Uma colher das de sopa tem capacidade para 10 mL, e a água sanitária usada tem concentração de hipoclorito de sódio igual a 37,25 g/L. A molaridade desta solução é igual a:
hipocloreto de sódio - NaClo
(Dados: Na = 23u; Cl = 25,5u e O = 16u)
a) 0,5 M b) 0,05 M c) 0,005 M d) 0,01 M e) 0,001 M
4) (UBERLÂNDIA) A concentração de ácido acético (C2H4O2) no vinagre é da ordem de 0,83 M. Aproximadamente, quantos gramas desse ácido há em 1 litro de vinagre?
Dados: C = 12; H = 1; O =16
a) 10 g b) 20 g c) 30 g d) 40 g e) 50 g
5) (MED – ITAJUBA) Quantos gramas de Na3PO4 (PM = 164) são necessárias para preparar 5,0 litros de uma solução 3 molar?
a) 10,9 b) 65,6 c) 98,4 d) 273 e) 2460
6) Uma solução de 5L contendo 100g de Fe2(SO4)3 apresentava concentração em mol/L e concentração em g/L, estas estão respectivamente iguais à?
a)0,10 e 10 b)0,20 e 40 c)0,15 e 25 d)0,60 e 40 e)0,05 e 20
dados: Fe=56, S=32, O=16.
7) Evapora-se totalmente o solvente de 250 mL de uma solução aquosade MgCl2 de concentração 8,0 g/L. Quantos gramas de MgCl2 são obtidos?
8) O rótulo de uma água mineral distribuída para o consumo informa que ela contém principalmente 696,35mg/L de bicarbonato de sódio (NaHCO3), além de outros componentes. Considerando que a massa molar de NaHCO3 é 84g/mol, qual será a concentração molar de bicarbonato nessa água?
9)- Para uma aula prática de química, um laboratorista necessita preparar 2 L de solução 0,5 mol/L de nitrato de prata. Nessecaso, calcule a massa de sal a ser utilizada.
(Dado: Ag = 108; N = 14; O = 16).
10)- Uma solução 0,2 mol/L de Cr2(SO4)3, suposto totalmente dissociado, tem que molaridades, em íons crômio e sulfato?
11)- Quantos gramas de brometo de cálcio estão dissolvidos em 30mL de solução 1,0.10-3 mol/L dessa substância? Que valor é esperado para a molaridade dos íons brometo nessa solução? (Dados: massa de um mol de brometo de cálcio = 200 g).
12) Qual é a molaridade de uma solução aquosa de etanol (C2H6O) de concentração 92g/L?
(Dado: massas atômicas: C = 12; H = 1; O = 16).

